Die GMP umfasst alle Maßnahmen, die konstant hohe Qualität bei der Produktion von Arzneimitteln sicherstellen.

Die Good Distribution Practice (GDP) ist ein Regelwerk, das sicherstellt, dass Arzneimittel während Lagerung und Transport ihre Qualität und Unversehrtheit behalten. Sie legt europaweit gültige Anforderungen für alle Stationen der Vertriebskette fest – vom Hersteller bis zur Apotheke – und schützt so vor Qualitätsverlust, Fälschung oder Kontamination.
Die Grundlage bildet die GDP-Leitlinie der Europäischen Union. Im Deutschen spricht man auch von der „Guten Vertriebspraxis“.
Personen, die zum Beispiel in einem regulierten Pharma-Unternehmen mit GDP-relevanter Logistik für ERP-, Logistik- oder Qualitätsprozesse verantwortlich sind, müssen zahlreiche Anforderungen sicherstellen. Das umfasst, dass die Herstellung, die Lagerung sowie der Transport ihrer Produkte und auch die dazugehörige Dokumentation gesetzlich abgesichert und nachvollziehbar sind.
Die GDP ist dabei Pflicht und stellt hohe Anforderungen an Prozesse, Systeme und Nachweise. Softwarelösungen wie ERP-Systeme spielen eine zentrale Rolle, um diese Anforderungen digital, transparent und effizient umzusetzen.
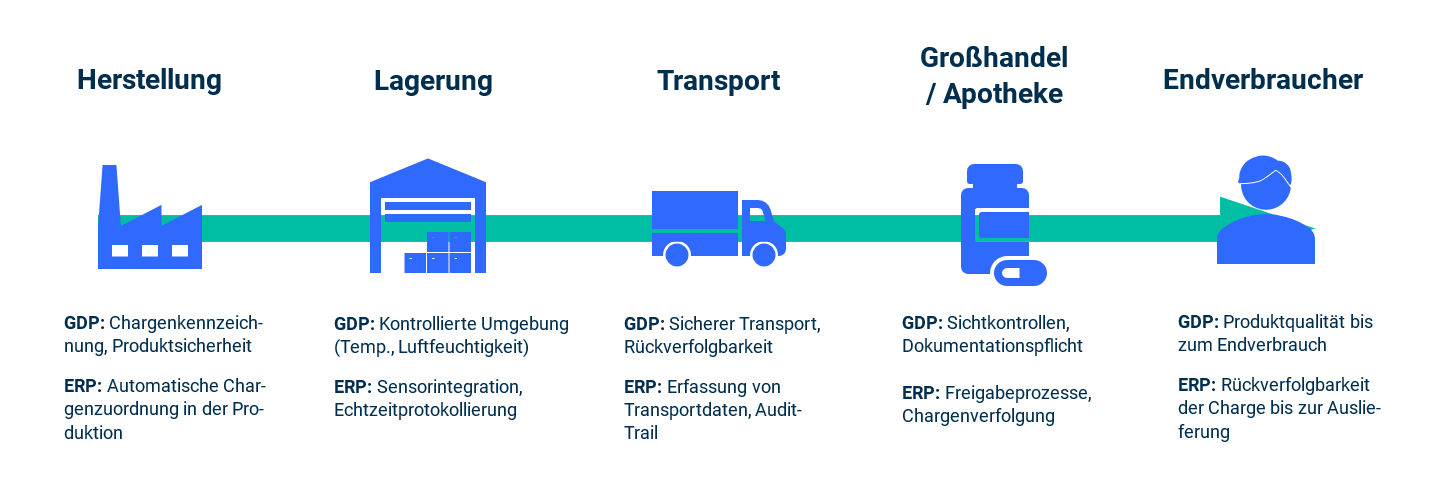
Die Good Distribution Practice gilt für alle Unternehmen, die an der Lagerung, dem Transport oder dem Vertrieb von Arzneimitteln beteiligt sind. Dazu zählen in erster Linie Hersteller in der Pharmaindustrie, aber auch Großhändler, Logistikdienstleister sowie externe Partner wie Softwareanbieter, die GDP-relevante Prozesse digital unterstützen.
Da sich die GDP-Leitlinie auf die gesamte Supply Chain von Arzneimitteln erstreckt – vom Versand bis zur Anlieferung beim Empfänger – müssen alle Beteiligten entsprechende Anforderungen erfüllen. Ein offizielles GDP-Zertifikat weist nach, dass ein Unternehmen die Vorgaben einhält.
Die GDP ist ein Bestandteil der sogenannten GxP-Vorgaben, zu denen unter anderem auch die Good Manufacturing Practice (GMP) zählt.
Die GDP-Leitlinie der Europäischen Union legt konkrete Anforderungen für alle Bereiche entlang der Arzneimittel-Vertriebskette fest. Sie ist in zehn Kapitel unterteilt, die jeweils spezifische Vorgaben für Qualität, Prozesse und Verantwortlichkeiten enthalten. Ziel ist es, die Sicherheit und Qualität von Arzneimitteln im gesamten Vertriebsprozess sicherzustellen.
Die zehn Kapitel der GDP-Leitlinie im Überblick:
Weitere offizielle Quellen & Informationen:
Die Einhaltung der Good Distribution Practice wird von den zuständigen Behörden der EU-Mitgliedstaaten überwacht. In Deutschland sind hierfür die jeweils zuständigen Inspektorate der Bundesländer verantwortlich.
Bei einer GDP-Inspektion prüfen die Aufsichtsbehörden, ob die Vorgaben der Leitlinie im Unternehmen korrekt und wirksam umgesetzt werden. Dabei werden unter anderem Räumlichkeiten, logistische Prozesse sowie die Vorgabe- und Nachweisdokumentation begutachtet. Ziel ist es, die GDP-Compliance nachweisbar sicherzustellen.
Typischer Anwendungsfall:
Ein ERP-System wie die ERP-Branchenlösung von Yaveon auf Microsoft Basis unterstützt Unternehmen dabei, alle relevanten GDP-Daten – von Lieferantenqualifizierung bis zur Chargenverfolgung – systematisch zu dokumentieren. So können Prüfnachweise bei Inspektionen digital und revisionssicher bereitgestellt werden.
Die Good Distribution Practice basiert auf der Richtlinie 2001/83/EG des Europäischen Parlaments, insbesondere auf den Artikeln 84 und 85b (3). Diese Artikel regeln die Anforderungen an die Lagerung, den Transport und den Vertrieb von Humanarzneimitteln innerhalb der EU.
In Deutschland sind die Vorgaben über § 1a der Arzneimittelhandelsverordnung (AM-HandelsV) in nationales Recht überführt. Dort wird unter anderem ein wirksames Qualitätssicherungssystem für Großhändler verpflichtend vorgeschrieben.
Damit ist GDP verbindlich vorgeschrieben und bildet die gesetzliche Grundlage für die sichere und nachvollziehbare Distribution von Arzneimitteln in Europa.
Ein GDP-Zertifikat können grundsätzlich alle Unternehmen erhalten, die an der Lieferkette im Gesundheitswesen beteiligt sind – vorausgesetzt, sie erfüllen die in der GDP-Leitlinie festgelegten Anforderungen. Dazu zählen unter anderem Spediteure, Lagerhalter, Logistikdienstleister, Transportunternehmen und Arzneimittelvermittler.
Die Zertifizierung erfolgt durch die zuständige Aufsichtsbehörde und bescheinigt, dass das Unternehmen GDP-konform arbeitet. Sie ist häufig Voraussetzung für die Zulassung als Dienstleister in der Pharma-Logistik und schafft Vertrauen bei Auftraggebern aus der pharmazeutischen Industrie.
Darüber hinaus kann eine GDP-Zertifizierung ein Wettbewerbsvorteil sein – sie signalisiert Qualitätsbewusstsein, Zuverlässigkeit und regulatorische Kompetenz.
Die Zertifizierung nach GDP erfolgt in mehreren Schritten und wird in der Regel von einer zuständigen Behörde oder akkreditierten Prüfstelle durchgeführt. Der Ablauf umfasst:
1. Vorbereitung & Planung
Klärung offener Fragen und Definition des Prüfungsumfangs sowie der nächsten Schritte.
2. Vor-Ort-Audit
Durchführung eines GDP-Audits beim Unternehmen inklusive Prüfung relevanter Prozesse, Dokumente und Räumlichkeiten.
3. Auditbericht & Bewertung
Erstellung eines Berichts mit einer Bewertung der Ergebnisse und ggf. Maßnahmenempfehlungen.
4. Ausstellung des GDP-Zertifikats
Bei erfolgreicher Prüfung wird das GDP-Zertifikat erteilt.
5. Regelmäßige Überwachung
Ein Überwachungsaudit findet in der Regel jährlich statt, um die fortlaufende Einhaltung der GDP-Anforderungen sicherzustellen.
6. Rezertifizierung nach drei Jahren
Nach Ablauf von drei Jahren erfolgt eine vollständige Rezertifizierung, die einem erneuten Hauptaudit entspricht.
Der GDP-Transport stellt sicher, dass pharmazeutische Produkte während des Transports sicher, effizient und gemäß den geltenden Vorschriften gehandhabt werden. Diese Praxis ist ein zentraler Bestandteil der GDP-Pharma-Transporte und umfasst Maßnahmen zur Aufrechterhaltung der richtigen Temperatur, Feuchtigkeit und Hygiene, um die Integrität der Produkte zu gewährleisten.
Darüber hinaus sind spezielle Verpackungen und kontinuierliche Überwachungssysteme erforderlich, um Risiken wie Kontamination und Beschädigung zu minimieren. Durch die Einhaltung der GDP-Richtlinien im Pharmatransport wird sichergestellt, dass Medikamente in einwandfreiem Zustand und ohne Qualitätseinbußen beim Endverbraucher ankommen.
Die ERP-Branchenlösung von Yaveon ist eine spezialisierte Lösung für Unternehmen in der Prozessindustrie – mit einem besonderen Fokus auf regulierte Branchen wie die pharmazeutische Industrie. Die Software unterstützt dabei, die Anforderungen der Good Distribution Practice (GDP) zuverlässig und effizient umzusetzen.
 Good Manufacturing Practice (GMP) – Beitrag öffnen
Good Manufacturing Practice (GMP) – Beitrag öffnen
Die GMP umfasst alle Maßnahmen, die konstant hohe Qualität bei der Produktion von Arzneimitteln sicherstellen.
 Was ist GxP und wer legt die Richtlinien fest? – Beitrag öffnen
Was ist GxP und wer legt die Richtlinien fest? – Beitrag öffnen
Gxp steht für "Gute Praktiken" und meint eine Sammlung von Richtlinien, um Qualität und Compliance zu gewährleisten.
 Was ist ein Audit? | Typen, Normen und mehr – Beitrag öffnen
Was ist ein Audit? | Typen, Normen und mehr – Beitrag öffnen
Ein Audit ist ein dokumentiertes Untersuchungsverfahren aus dem QM, das von Auditoren durchgeführt wird.