Computersystemvalidierung beschreibt den Prozess, der sicherstellt, dass Software tut, wofür sie entwickelt wurde.

Das Wort „Validieren“ stammt vom lateinischen „valere“ ab, was auf Deutsch „den Wert festlegen“ bedeutet. Bei der Validierung wird ein dokumentierter Nachweis erbracht, dass ein Prozess vorab definierte Ergebnisse liefert. So wird sichergestellt, dass Prozesse so ablaufen, dass für den Menschen keine Gefährdung entsteht.
Das Ziel aller Prozesse ist das repetitive Erbringen gleicher, vorher definierter Ergebnisse. Die Prozesse sollen dabei so gesteuert werden, dass eine gleichbleibende Qualität erzeugt wird. Weil sie genau das sicherstellen soll, hat Validierung eine recht hohe Bedeutung in der Industrie. Es muss sich dabei nicht immer um den Begriff „Validierung“ handeln, die Verfahren ähneln sich jedoch stark.
So ist z. B. der Nachweis der Prozessfähigkeit von Herstellprozessen mit der Vorgehensweise in der „Validierung“ vergleichbar. Dies können Planungs-, Herstellungs-, Prüf- oder Logistikprozesse sein, die in einem Unternehmen alltäglich sind. Diese zu validieren, sprich die Prozesse so zu gestalten, dass sie immer qualitativ gewünschte Ergebnisse liefern, ist das Bestreben.
Die Validierung dient dazu, vorab zu bestätigen, dass die Prozesse dazu in der Lage sind. Die Dokumentation zu dieser Eigenschaft ist die Validierung. Die Anforderungen an die (Prozess)Validierung sind in den einzelnen Branchen unterschiedlich, sie folgen in der Regel jedoch immer dem gleichen Muster.
Validierung wird nicht nur den Regularien des GxP-Umfeldes gerecht, sondern kommt auch häufig in selbstregulierten Branchen (z. B. Automobilindustrie) vor. Validierung stellt in den sensiblen Branchen einen grundlegenden Baustein dar. Sie stellt sicher, dass Prozesse immer wieder (also reproduzierbar) gleichbleibende Ergebnisse liefern.
Es wird also festgestellt, dass ein Endprodukt unter konstanten Bedingungen immer gleich hergestellt werden kann. Einerseits soll damit die gleichbleibende Produktqualität sichergestellt werden und zudem werden durch eine gesicherte Produktion Kosten gespart.
Die Validierung hat im pharmazeutischen Umfeld vor allem die Patientensicherheit im Fokus. Es geht in erste Linie darum, eine gute Prozessstabilität und -qualität zu erreichen und dies auch im Zuge der Validierung zu bestätigen und zu dokumentieren. Daneben verfolgt Validierung noch weitere Ziele:
Der größte Vorteil der Validierung besteht darin, dass sie ein Hilfsmittel zur Prozessbeherrschung ist und damit in erster Linie durch Fehler- und damit Kostenvermeidung Kostenvorteile bringt. Auch weitere Aufwendungen, z.B. durch strengere Qualitätskontrollen, können durch die erhöhte Prozesssicherheit reduziert werden. Denn Prüfungen können ausgesetzt oder der Prüfumfang reduziert werden.
In der stringenten Forderung nach Dokumentation besteht ein weiterer Vorteil darin, dass der Status Quo von Prozessen und Verfahren jederzeit nachvollzogen werden kann (z. B. bei Einarbeitung neuer Mitarbeiter) und Änderungen wiederum leichter bewertet und dokumentiert werden können. Das führt zudem dazu,
Grundsätzlich basiert die Vorgehensweise darauf, dass Anforderungen (an einen Prozess, an eine Maschine oder Anlage, an ein Computersystem usw.) definiert werden (Lastenheft). Zudem wird beschrieben, wie diese umgesetzt werden und welche Einrichtungen dafür (z. B. Rechte, Parametrierung) erforderlich sind (Pflichtenheft). Die Umsetzung wird dokumentiert und die Funktionen sowie die Erfüllung der Anforderungen werden anhand definierter Testpläne getestet und dokumentiert.
Dieser Ablauf wird häufig in einem V-Modell dargestellt. Im GMP-Umfeld wurde mit GAMP (Good Automated Manufacturing Practice, derzeit in Version 5) eine Best Practice geschaffen, die gerne als standardisierte Vorgehensweise auch in anderen Branchen (z. B. Medizinprodukte) in der Validierung verwendet wird.
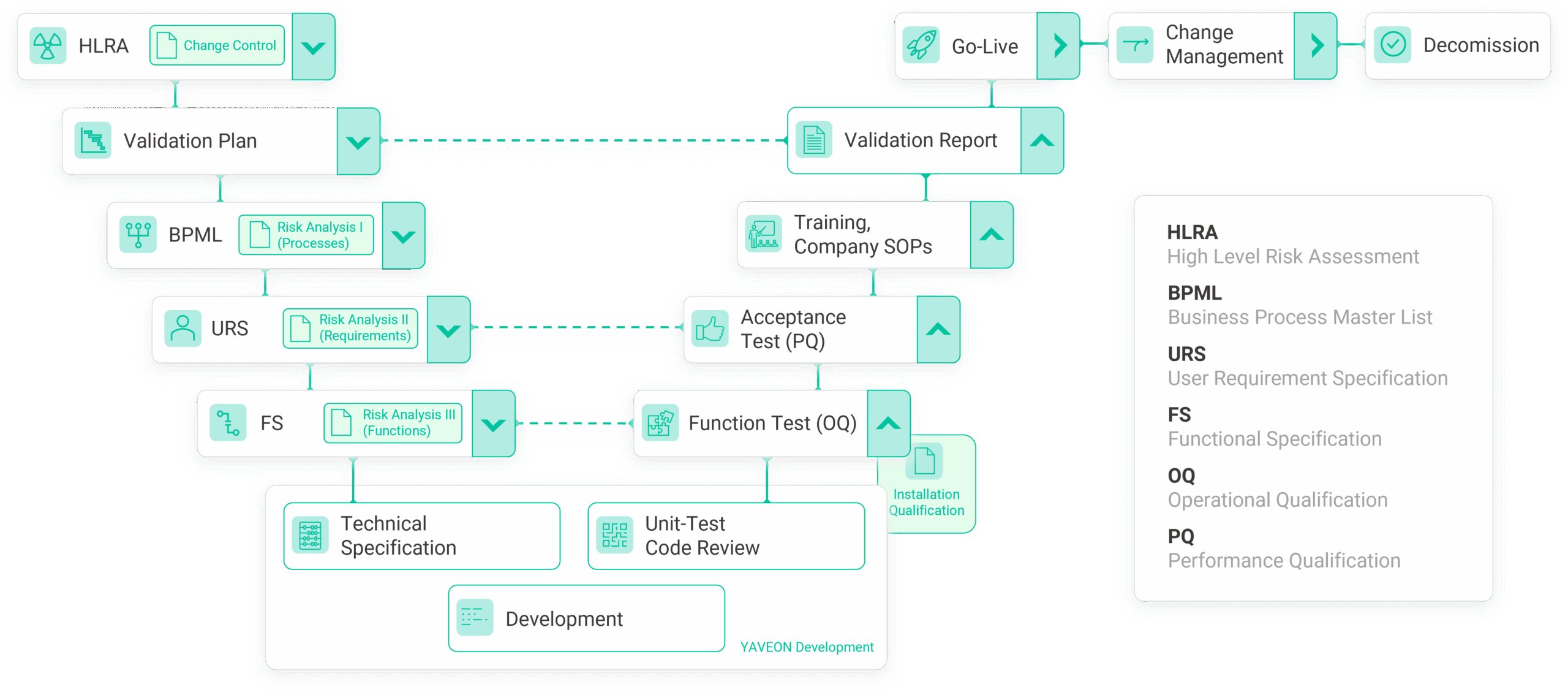
In diesem Zusammenhang beziehen sich die Begriffe auf die digitale Welt der Computer. Während bei der Validierung im Bereich Computersysteme belegt wird, dass ein Prozess vorab definierte Ergebnisse liefert, beschäftigt sich Qualifizierung mit der Hardware und der Systemumgebung.
Qualifizierung ist ein Eignungsnachweis, dass Hardware und Infrastruktur einwandfrei funktionieren. Sie sagt aus, dass die Ausrüstung das leisten kann, was von ihr gefordert wird.
Wie beschrieben, bedeutet Validierung zunächst einmal die Bestätigung der Prozessfähigkeit. Auf die Qualität eines Prozesses haben jedoch zahlreiche Faktoren einen Einfluss, wie die Prozessgestaltung, die dazugehörigen Maschinen und Anlagen, das Bedienungspersonal oder sonstige Systeme, wie z. B. Computer. Damit sprechen wir von Validierung eines beispielsweise Produktionsprozesses.
Wird ein Produktionsprozess durch ein Computersystem unterstützt, ist der Einsatz des Computersystems ebenfalls zu validieren, was sich Computersystemvalidierung (CSV) nennt. CSV bedeutet daher die Validierung eines Prozess in Hinblick auf den Einsatz eines Computersystems.
Von Verifizierung wird gesprochen, wenn es darum geht, mit objektiven Mitteln zu prüfen, ob bestimmte Eigenschaften erfolgreich erfüllt sind. Der Vorgang kann sich beispielsweise auf Produkte oder Komponenten beziehen. Es wird also geprüft, ob ein Produkt die Spezifikationen, die vorab festgelegt wurden, vollends erfüllt.
Bei der Validierung hingegen geht es darum zu prüfen, dass ein Prozess vorab definierte Ergebnisse wiederholt erzielen kann.
In Bezug auf Software-Lösungen spricht man von Computersystemvalidierung. Grundlage hierfür sind GMP-Richtlinien, die vorschreiben, dass:
Bei der FDA hat das Thema Computersystemvalidierung ebenfalls Relevanz: Softwarevalidierung muss demnach bestätigen, dass Software-Spezifikationen den Benutzeranforderungen und dem Verwendungszweck entsprechend umgesetzt und Anforderungen durchgängig erfüllt werden. Dafür werden objektive Nachweise untersucht und erbracht.
Validierung ist besonders in den Branchen Pharmazie und Medizintechnik relevant. Der Grund dafür ist die geforderte und nötige Präzision. Bei der Pharma- und Medizintechnik-Branche handelt es sich um sensible Bereiche – das exakte Erreichen der vorab festgelegten Kriterien ist enorm wichtig. Nur so können Produkte, beispielsweise Medikamente, zuverlässig hergestellt werden, und der Verbraucher hat die Sicherheit, auf kontinuierliche Produktqualität zurückzugreifen.
Bei der Validierung in der pharmazeutischen Herstellung wird sichergestellt, dass das Endprodukt unter identischen Umgebungsbedingungen wie Temperatur immer die erforderlichen Qualitätsstandards erreicht und das gleiche Ergebnis erzielt. Jedes neue Produkt erfordert, unabhängig von der Nutzung identischer oder ähnlicher Ausrüstungen, eine erneute Validierung.
Für die Durchführung einer solchen Prozessvalidierung wird ein spezifischer Validierungsplan entwickelt, der den gesetzlichen Richtlinien (u.a. EU-GMP, FDA oder PIC/S) entsprechen muss. Die in diesem Plan vorgesehenen Verfahren müssen mit den Validierungsarbeitsanweisungen übereinstimmen. Die Übereinstimmung wird von verantwortlichen Personen wie dem Laborleiter oder dem Leiter der Qualitätssicherung überprüft und durch Unterschrift bestätigt. Nach der Umsetzung des Validierungsplans wird ein ausführlicher Bericht verfasst, der die Resultate und eventuelle Abweichungen festhält und bewertet. Dieser Bericht ähnelt einem detaillierten Prüfbericht, wie er etwa bei Fahrzeuginspektionen angefertigt wird. Nur die validierten Methoden und Prozesse dürfen für die Produktion und Kontrolle von Medikamenten genutzt werden, die zum Verkauf bestimmt sind.
Mit der steigenden Relevanz computergestützter Systeme in der pharmazeutischen Herstellung müssen auch diese den geforderten Regularien entsprechen und validiert werden. Dazu zählen u.a. ERP-Systeme, Dokumentenmanagementsysteme, Manufacturing Execution Systeme oder Labor-Informationsmanagement-Systeme.
Die Validierung von Medizinprodukten ist ein entscheidender Prozess, um die Sicherheit und Wirksamkeit dieser Produkte zu gewährleisten. Um auf dem Markt zugelassen zu werden, müssen Medizinprodukte eine Reihe von Normen erfüllen, darunter die ISO 13485, die die Anforderungen an ein Qualitätsmanagementsystem festlegt, und die ISO 14971 für das Risikomanagement.
Der Validierungsprozess umfasst die sorgfältige Prüfung und Dokumentation aller Design-, Produktions- und Nutzungsphasen. Dabei wird nicht nur die physische Komponente des Produkts untersucht, sondern auch eventuelle Software oder computergestützte Systeme. Diese müssen auf korrekte Funktionalität, Benutzerfreundlichkeit und Integration in bestehende Systeme überprüft werden.
Die Methodik folgt einem strukturierten Ansatz: von der Definition der Anforderungen über mehrere Testphasen bis hin zur abschließenden Bewertung. Dies stellt sicher, dass das Medizinprodukt konsistent die erwarteten Leistungen erbringt und den gesetzlichen Vorschriften entspricht.
Die Validierung von ERP-Systemen ist ein entscheidender Prozess, der gewährleisten soll, dass diese Systeme den spezifischen Anforderungen einer Organisation gerecht werden und zuverlässig funktionieren.
Dabei ergeben sich jedoch verschiedene Herausforderungen:
Insgesamt stellt die Validierung von ERP-Systemen eine komplexe Balance zwischen einer gründlichen Überprüfung und den damit verbundenen zeitlichen sowie finanziellen Aufwänden dar, was für Unternehmen eine kontinuierliche Herausforderung bleibt.
Yaveon 365 hebt sich als ein ERP-System hervor, das den besonderen Anforderungen der Computersystemvalidierung in regulierten Industrien wie der Medizintechnik- & Pharmabranche gerecht wird.
 Alles zur Validierung von Computersystemen – Beitrag öffnen
Alles zur Validierung von Computersystemen – Beitrag öffnen
Computersystemvalidierung beschreibt den Prozess, der sicherstellt, dass Software tut, wofür sie entwickelt wurde.
 Was ist GAMP5? | Prinzipien, Ablauf und mehr – Beitrag öffnen
Was ist GAMP5? | Prinzipien, Ablauf und mehr – Beitrag öffnen
GAMP 5 ist der Leitfaden, um Qualität und Compliance automatisierter Systeme sicherzustellen.
 Alles rund um Softwarevalidierung – Beitrag öffnen
Alles rund um Softwarevalidierung – Beitrag öffnen
Softwarevalidierung prüft, dass Software den Anforderungen gerecht wird und sich für den vorgesehenen Zweck eignet.